jueves, 29 de mayo de 2014
NOMENCLATURA DE ALCANOS
NOMENCLATURA DE ALCANOS
Las reglas de nomenclatura para compuestos orgánicos e inorgánicos son establecidas por la Unión Internacional de Química pura y aplicada, IUPAC (de sus siglas en inglés). (Ver: Nomenclatura química)
En este capítulo profundizaremos sobre las reglas para la nomenclatura de alcanos (hidrocarburos con enlaces sencillos) ya que éstas constituyen la base de la nomenclatura de los compuestos orgánicos. (Para mejor comprensión del tema ir primero a:Radicales).
Estas reglas son las siguientes:
1.- La base del nombre distintivo es la cadena continua más larga de átomos de carbono.
2.- La numeración correlativa de los átomos de carbono se inicia por el extremo más cercano a una ramificación (es lo mismo que decir un sustituyente o un radical). En caso de encontrar dos ramificaciones a la misma distancia, se empieza a numerar por orden alfabético desde el extremo más cercano a la ramificación de menor orden alfabético. Si se encuentran dos ramificaciones del mismo nombre a la misma distancia de cada uno de los extremos, se busca una tercera ramificación y se numera la cadena por el extremo más cercano a ella.
3.- Si se encuentran dos o más cadenas con el mismo número de átomos de carbono, se selecciona la que deje fuera losradicales alquilo más sencillos. En los isómeros se toma los lineales como más simples. El n-propil es menos complejo que elisopropil. El ter-butil es el más complejo de los radicales alquilo de 4 carbonos.
4.- Cuando en un compuesto hay dos o más ramificaciones iguales, no se repite el nombre, luego de colocar los números que corresponden a las ubicaciones de dichos radicales se le añade el nombre con un prefijo numeral.
Los prefijos numerales son:
Número |
Prefijo
|
2
|
di o bi
|
3
|
tri
|
4
|
tetra
|
5
|
penta
|
6
|
hexa
|
7
|
hepta
|
6.- Se escriben las ramificaciones (no olvidar: sustituyentes o radicles, es lo mismo) en orden alfabético y el nombre del alcano que corresponda a la cadena principal se agrega al nombre del último radical.
Al ordenar alfabéticamente, los prefijos numerales y los prefijos n-, sec- y ter- no se toman en cuenta.
7.- Por convención, los números y las palabras se separan mediante un guión, y los números entre si, se separan por comas.
La comprensión y el uso adecuado de las reglas señaladas facilitan la escritura de nombres y fórmulas de compuestos orgánicos.
Radicales alquilo
Ya sabemos que cuando alguno de los alcanos pierde un átomo de hidrógeno se forma un radical alquilo. Estos radicales aparecen como ramificaciones sustituyendo átomos de hidrógeno en las cadenas.
| Los radicales alquilo de uso más común son: | |
| — CH3 | — CH2 — CH3 |
Metil o Metilo
|
Etil o Etilo
|
| — CH2 — CH2 — CH3 | — CH2 — CH2 — CH2 — CH3 |
n-Propil o n-Propilo
|
n-Butil on-Butilo
|
isopropil o Isopropilo
|
Isobutil o Isobutilo
|
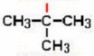 | |
sec-Butil o sec-Butilo
|
ter-Butil o ter-Butilo
|
Las líneas rojas indican el enlace con el cual el radical se une a la cadena principal. Esto es muy importante, el radical no puede unirse por cualquiera de sus carbonos, sólo por el que tiene el enlace libre.
Ejemplos de nomenclatura de alcanos
1)
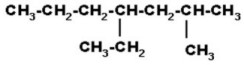 |
Se define la cadena de carbonos continua más larga y se numera desde el extremo más cercano a un radical, y se identifican todos los radicales que haya.
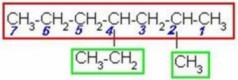 |
La cadena continua más larga tiene 7 carbonos y se empezó la numeración desde la derecha porque ahí está el radical más cercano (CH3). Identificamos los radicales y el número del carbono al que están unidos (2-metil y 4-etil), los anotamos en orden alfabético (no importa el número) y al último radical le unimos el nombre de la cadena, y nos queda: 4-etil-2-metilheptano
2)
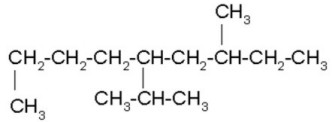 |
Buscamos la cadena continua de carbonos más larga, la cual no tiene que ser siempre horizontal. Numeramos por el extremo más cercano a un radical, que es el derecho. Ordenamos los radicales en orden alfabético y unimos el nombre de la cadena al último radical.
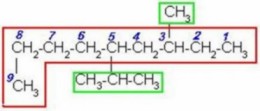 |
5-isopropil-3-metilnonano
3)
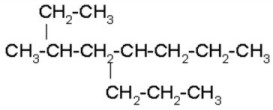 |
Buscamos la cadena de carbonos continua más larga, numeramos por el extremo más cercano al primer radical, que en este caso es del lado izquierdo. Nombramos los radicales con su respectivo número en orden alfabético y unimos el nombre de la cadena al último radical.
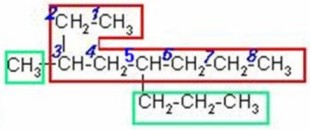 |
3-metil-5-n-propiloctano
4)
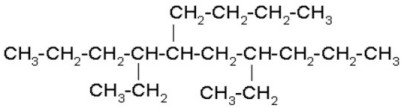 |
Seleccionamos la cadena continua de carbonos más larga. Al tratar de numerar observamos que a la misma distancia de ambos extremos hay un radical etil, entonces nos basamos en el siguiente radical, el n-butil para empezar a numerar.
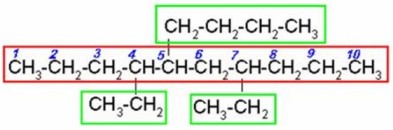 |
Recuerde que el n-butil por tener guión se acomoda de acuerdo a la letra b, y no con la n:.5-n –butil-4,7-dietildecano
5)
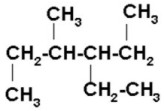 |
Al seleccionar la cadena de carbonos continua más larga observamos que a la misma distancia de cada extremo hay un radical, un metil y un etil, entonces iniciamos la numeración por el extremo más cercano al etil ya que es el radical de menor orden alfabético.
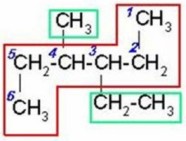 |
3-etil-4-metilhexano
Si conocemos el nombre del compuesto
En otros casos es posible que nos den el nombre del compuesto y a partir de éste graficar la fórmula estructural del mismo:
Ejemplos:
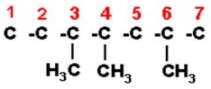
1) 3,4,6-trimetil heptano
Graficamos la cadena heptano, que tiene siete átomos de carbono. Los numeramos de izquierda a derecha, pero se puede hacer de izquierda a derecha.
Ahora colocamos los radicales en el carbono que les corresponda (Un metil en el 3, un metil en el 4 y un metil en el 6, que es igual a 3,4,6 –trimetil). Tenga cuidado de colocar el radical por el enlace libre.
 |
Como el carbono forma 4 enlaces, completamos nuestra estructura con los hidrógenos necesarios para que cada uno tenga sus 4 enlaces.
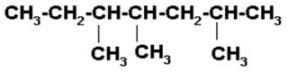 |
2) 3-metil-5-isopropilnonano
Nonano indica que es una cadena de 9 carbonos.
Colocamos los radicales (un metil en el 3, un isopropil en el 5)
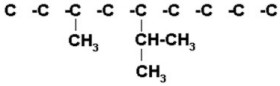 |
Los radicales pueden acomodarse de diferentes formas, siempre y cuando conserve su estructural.
Finalmente completamos con los hidrógenos necesarios para que cada carbono tenga sus 4 enlaces.
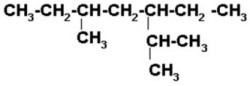 |
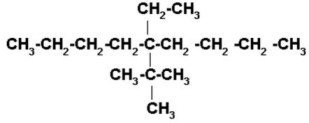
4) 5-ter-butil-5-etildecano
Decano es una cadena de 10 carbonos.
Los dos radicales de la estructura están en el mismo carbono (el Nº 5) por lo tanto se coloca uno arriba y el otro abajo del carbono 5, indistintamente.
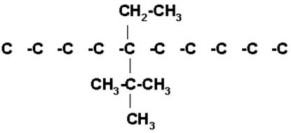 |
Completamos con los hidrógenos
 |
5) 5-sec-butil-5-ter-butil-8-metilnonano
Nonano es una cadena de 9 carbonos.
Colocamos los radicales.
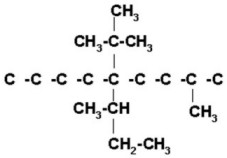 |
Ahora completamos con hidrógeno para que cada carbono tenga 4 enlaces.
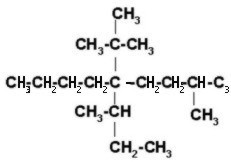 |
6) 5-isobutil-4-isopropil-6-n-propildecano
Decano es una cadena de 10 carbonos que numeramos de izquierda derecha.
Colocamos los radicales cuidando de acomodarlos en forma correcta.
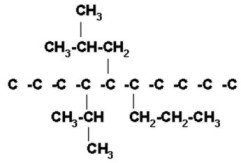 |
Contamos los enlaces para poner los hidrógenos necesarios para completar 4 enlaces a cada carbono.
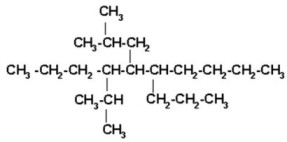 |
lunes, 5 de mayo de 2014
LOS HIDROCARBUROS
LOS HIDROCARBUROS
¦ Saturados ¦ Alcanos
¦ Alifáticos ¦
¦ ¦ ¦ Alquenos
¦ ¦ Insaturados ¦
Hidrocarburos ¦ ¦ Alquinos
¦
¦ Aromáticos
ALCANOS1.- Cadena más larga: metano, etano, propano, butano, pentano,...
2.- Las ramificaciones como radicales: metil(o), etil(o),...
3.- Se numera para obtener los números más bajos en las ramificaciones.
4.- Se escriben los radicales por orden alfabético y con los prefijos di-, tri-, ... si fuese necesario.
5.- Los hidrocarburos cíclicos anteponen el prefijo ciclo-
Propiedades físicas
CH4 + Cl2 ----> CH3Cl + HCl
AlCl3
CH3CH2CH2CH3 ------> CH3CH(CH3)2
Obtención de alcanos
- Hidrogenación de alcanos:
Ni
CH3CH=CHCH3 -----> CH3CH2CH2CH3
- Reducción de haluros de alquilo: Zn
2 CH3CH2CHCH3 ------> 2 CH3CH2CH2CH3 + ZnBr2
ALQUENOS1.- Seleccionar la cadena principal: mayor número de dobles enlaces y más larga. Sufijo -eno.
2.- Numerar para obtener números menores en los dobles enlaces.
Propiedades físicas
CH3-CH=CH-CH3 + XY ------> CH3-CHX-CHY-CH3entre ellas destacan la hidrogenación, la halogenación, la hidrohalogenación y la hidratación. En estas dos últimas se sigue la regla de Markovnikov y se forman los derivados más sustituidos, debido a que el mecanismo transcurre mediante carbocationes y se forma el carbocatión más estable que es el más sustituido.
CH3-CHX-CHY-CH3 ------> CH3CH=CHCH3 + XYentre ellas destacan la deshidrogenación, la deshalogenación, la deshidrohalogenación y la deshidratación. Las deshidratación es un ejemplo interesante, el mecanismo transcurre a traves de un carbocatión y esto hace que la reactividad de los alcoholes sea mayor cuanto más sustituidos. En algunos casos se producen rearreglos de carbonos para obtener el carbocatión más sustituido que es más estable. De igual modo el alqueno que se produce es el más sustituido pues es el más estable. Esto provoca en algunos casos la migración de un protón.ALQUINOS
1.- Se consideran como dobles enlaces al elegir la cadena principal.
2.- Se numera dando preferencia a los dobles enlaces.
Suscribirse a:
Entradas (Atom)



